Соли в химии — общая характеристика, классификация и примеры соединений с названиями
Содержание:
- Классификация простых веществ
- Где находится соль и кто ее добывает
- Мифы о соли
- Продукты, которые способны ухудшить или улучшить общее состояние
- Физические свойства соли
- Классификация
- Типы солей
- Применение солей
- Полезные свойства соли
- Свойства солей в электролитах
- Химический состав пищевой соли
- Соляная кислота как профессиональная вредность
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе— это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
| металлы | неметаллы | ||
| Тип химической связи | металлическая | ковалентная неполярная | |
| Кристаллическая решётка | металлическая | атомная или молекулярная | |
| Физические свойства | Агрегатное состояние | твёрдые, кроме жидкой ртути Hg |
|
| Блеск | металлический блеск | не обладают блеском (исключение: йод J2 и графит) | |
| Способность проводить тепло и электрический ток | хорошие проводники | плохо проводят тепло, не проводят ток — диэлектрики (исключение: графит, кремний Si и черный фосфор) | |
| Прочность, ковкость, пластичность | характерно для всех металлов (исключение: хром Cr, марганец Mn, сурьма Sb) | в твердом состоянии хрупкие | |
| Цвет | серебристо-белый, серебристо-серый (исключение: красная медь Cu, желтое золото Au и некоторые др.) | разный: почти черный йод J2, желтая сера S, черный, белый и красный фосфор P, бесцветные кислород O2, азот N2 | |
| Способность к аллотропии | слабая; некоторые металлы: железо Fe, олово Sn, лантаноиды и актиноиды. | хорошая; много модификаций у углерода С (графит, фуллерен, алмаз, карбин и др.); фосфора P (белый, чёрный, красный); серы S (кристаллическая, пластическая) | |
| Аллотропия — способность некоторых элементов существовать в виде двух или нескольких простых веществ (аллотропных модификаций), отличающихся по строению и свойствам. |
Таблица 1
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
- обнаруживаются в воздухе, в малых количествах — в воде, горных породах, природных газах;
- не имеют цвета, вкуса и запаха;
- крайне химически инертны;
- используются в источниках света для создания освещения различных цветов (Ne — огненно-красный, Xe— синевато-серый, тусклый, Ar — фиолетово-голубой и др).
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
- Свойства элементов, входящих в соединение, не сохраняются. Например, металл кальций Ca и неметалл хлор Cl2. Каждому из этих простых веществ присущи свои характеристики. А соль CaCl2 имеет новые, отличные от характеристик простых веществ, свойства, сходные со свойствами класса солей.
- В ходе химических реакций сложное вещество может быть получено или разложено на составные части.
- Количественный состав сложного соединения всегда одинаков, независимо от места нахождения и способа получения (для веществ молекулярного состава).
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
| Оксиды | Основания | Кислоты | Соли | |
| Составляющие | Элемент Э+кислород со степенью окисления -2 | Катион металла+гидроксид-анион OH- | атом водорода, способный замещаться на металл+кислотный остаток K | катион металла Me+анион кислотного остатка K |
| Формула | ЭnOm | Me+n(OH-)n | HnК | Me+nK-m |
| Примеры | Li2O, MgO, Fe2O3, CO2 | KOH, Ca(OH)2, Al(OH)3 | HCl, H2SO4, H3PO4 | NaNO3, CaCO3, Al2(SO4)3 |
| Агрегатное состояние |
|
твёрдые: NaOH, Mg(OH)2 |
|
твёрдые: KNO3, CaCO3, NaCl |
| По составу бывают: |
|
|
|
|
Таблица 2
Где находится соль и кто ее добывает
Богатейшие соляные запасы планеты разрабатывают более 100 стран. Натрий хлор содержится в морской воде, соляных озерах и под землей, залегая на глубине до 5 км. в виде соляных пластов. По подсчетам ученых, если вытопить весь натрий хлор из мирового океана, то земной шар можно покрыть 45 метровым слоем минерала.

Подпись: Мертвое море в Израиле — самое глубокое из соленых озер в мире
Россия входит в 20ку стран по объемы добычи белого богатства. Рейтинг возглавляют США, Австралия, Австрия и Бразилия. В нашей стране производство стремительно развивается. Россия близка к тому, чтобы самостоятельно обеспечивать солью внутренний рынок.
Интересно, что добыча поваренной соли в мире для приготовления пищи составляет 6%, для посыпания дорог – 17%, для промышленных целей – 77%.
Мифы о соли
Споры о пользе и вреде хлористого натрия зародились с давних времен, и не утихают по сей день. Одни утверждают о необходимости сокращения ежедневного приема соли до минимума. Другие, наоборот, призывают включить вкусовую добавку в дневной рацион, чтобы не «травмировать» организм.
Миф №1 «Соль – яд»
Это неправда. Хлористый натрий – ценнейший дар природы, который еще несколько столетий назад ценился на вес золота. Польза соли для человеческого организма неоценима. Ее хроническая нехватка может привести к летальному исходу. Входящие в состав продукта хлор и натрий участвуют в протекании жизненно важных функций: передаче нервных импульсов, транспорте кислорода в крови, осуществлении движений мускулов.
В умеренных количествах, не превышающих суточную норму, соль – продукт, поддерживающий здоровье человека. Однако при чрезмерном употреблении его польза обращается во вред. В таком случае выражение «соль – белый яд» полностью оправдано, поскольку гипернатриемия может убить человека в прямом смысле слова .
Миф №2 «Диета без соли»
В настоящее время бытует ошибочное предположение, что отказавшись от приема хлористого натрия, человек начинает терять килограммы за счет расщепления жира. Отчасти это правда. Бессолевая диета поможет ликвидировать до 4 килограмм за 14 дней. Однако в данном случае снижение веса происходит не из-за расщепления жировых отложений, а в результате обезвоживания организма. Вместе с жидкостью вымываются минералы (кальций, калий, магний), дефицит которых ведет к нарушению электролитного баланса в организме. Вследствие этого у человека наблюдается быстрая утомляемость, сухость волос и кожного покрова, потеря сил.
Нехватка соли в организме сопровождается развитием заболеваний сердечно-сосудистой системы, депрессивных состояний, возникновением остеопороза и анорексии.
На сегодняшний день диетологи сошлись во мнении, что бессолевая диета принесет больше вреда для организма человека, чем пользы .
Миф №3 «Отложение солей»
В организме человека зачастую откладываются соли желчной кислоты, кальция, фосфаты, ураты. Данная группа химических соединений не имеет никакого отношения к хлориду натрия. Самый важный аспект – соотношение количества потребляемой и выводимой соли. Интересно, что для поддержания жизнедеятельности, организм человека усваивает только недостающую часть хлористого натрия. При этом, излишек выводится с мочой. При нарушении обмена веществ соли начинают накапливаться в желчном пузыре, суставах, почках. В результате нарушается отток желчи, возникают сильные боли, происходит деструкция хрящей, воспаляются лоханки, формируются камни.
Таким образом, когда речь заходит о солях, имеется в виду не хлористый натрий, а содержание химических соединений в тканях .
Миф №4 «Разрушает зубы»
Правда, морская соль, если жевать ее кристаллы, может повредить эмаль. В остальных случаях данное утверждение не более, чем ошибочное. Соль употребляют в пищу исключительно в растворенном виде, в котором она не может нанести вред зубам. Наоборот, она вместе с содой используется для лечения язвочек в ротовой полости и укрепления десен .
Миф №5 «Повышает давление»
Излишек соли в организме вызывает развитие атеросклероза, негативно воздействует на механизм, контролирующий артериальное давление. Кроме того, при чрезмерном употреблении хлористого натрия резко повышается потребность в жидкости, что ведет к увеличению нагрузки на сердце и сосуды. В результате наблюдается отечность конечностей, а под глазами возникают мешки. Поэтому гипертоникам рекомендуется уменьшить суточную дозу соли .
Продукты, которые способны ухудшить или улучшить общее состояние
Список того, что нельзя кушать при ревматоидном артрите, открывают блюда, способные негативно повлиять на состояние желудка и кишечника. Это жареное, копчености, острые приправы, любые виды бульонов: мясной, грибной, рыбный и даже овощной.
С осторожностью употребляются фрукты и овощи, богатые кислотами. Но исключать их нельзя, поскольку организму необходимы антиоксиданты и особенно витамин С, флавоноиды, ниацин
Поэтому шиповник, сладкий перец, апельсины и различные ягоды включаются в меню. Можно пить зеленый чай. Пользу принесут отруби (пшеничные, рисовые). Хлеб — в небольших количествах.
Обязательно необходимы источники полноценного белка, хондропротекторов, омега-3 жирные кислоты, минералы. К ним относится следующий ряд продуктов:
- куриные и перепелиные яйца;
- фрукты;
- овощи;
- зелень;
- орехи;
- морская рыба и морепродукты;
- заливные блюда, желе;
- хрящевые субпродукты (уши, ножки, пятачки);
- льняное масло.
Во время ремиссии разрешается употреблять сладости, мед, джем или варенье. А вот кофе и черный чай разрешены только некрепкие. Диета при ревматоидном артрите как серопозитивного, так и серонегативного типа, полностью исключает газированные напитки и алкоголь.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая — содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.
По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые — ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.
Классификация
Сегодня существует множество разновидностей соли, которая отличается по цвету, вкусу, химическому составу, а также степени помола и очистки. Среди широкого ассортимента несложно растеряться. Какой же из них отдать предпочтение?
Виды соли:
- Йодированная. Полезна людям, проживающим в экологически неблагоприятных районах. Противопоказана при гиперактивности щитовидной железы.
- Экстра. Представляет собой «агрессивный» вид соли, поскольку в его состав входит исключительно чистый хлорид натрия. В процессе производства продукта (выпаривания воды, очистки содой) уничтожаются все полезные микроэлементы, поэтому она практически не представляет ценности для организма человека.
- Каменная. Это натуральная соль сероватого цвета, добываемая из шахт.
- Черная. Представляет собой природный неочищенный продукт. Улучшает пищеварение, оказывает слабительный эффект. Черная соль содержит калий, йод, серу, железо.
- Поваренная. По сути, это отбеленная каменная соль, в гранулах.
- Морская. Самый полезный продукт, природный источник микроэлементов. В ее состав входят: натрий, хлор, кальций, калий, фосфор, магний, марганец, цинк, железо, селен, медь, кремний, йод .
Морскую соль извлекают из водных просторов планеты. Она гораздо полезнее, чем каменная или поваренная. Ее цвет (серый, розовый, черный, красный) и вкус (насыщенный, нежный или острый) определяются местными видами водорослей и глины, сосредоточенными в испарительных прудах. Используется для лечения гайморита, пневмонии, пародонтоза, гипертонии, ревматизма, при отравлениях.
По месту добычи различают следующие подвиды морской соли: «Малдонская» (Англия), «Terre de Sel» и «Sel gris» (Франция), «Rose» (Боливия), «Гималайская» (Пакистан), «Гавайская красная» или «Гавайская черная», «Кala namak» (Индия), «Персидская синяя» (Иран).
- Диетическая. Отличительная особенность данного вида – пониженное содержание натрия. В состав диетической соли входят калий и магний, поддерживающие работу сердца и сосудов.
Соль классифицируют по способу помола (крупная, средняя, мелкая), чистоте (высший, первый, второй сорт).
Продукт активно используют в пищевой промышленности, медицине, косметологии.
В кулинарии крупную соль используют исключительно для консервирования овощей, засолки рыбы, приготовления супов, круп. Средний помол применяется для улучшения вкуса маринада, сухого посола мяса, запекания рыбы. Мелкую соль добавляют в готовые блюда (закуски, салаты), подают к столу. Она быстро растворяется, не скрипит на зубах.
Рассмотрим в чем уникальность такого дарования природы.
Типы солей
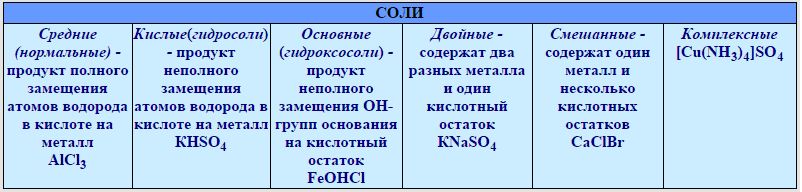
А теперь давайте более подробно рассмотрим классификацию солей.
Классификация:
• К кислым солям относятся такие, в которых атомы водорода в кислоте частично заменены атомами металла. Их можно получить с помощью нейтрализации основания избытком кислоты.
• К средним солям или как их еще нормальным, относятся такие соли, у которых в молекулах кислоты все атомы водорода замещены на атомы металла, например, таких, как Na2CO3, KNO3 и т.д.
• К основным солям относятся те, где у которых происходить неполное или частичное замещение гидроксильных групп оснований кислотными остатками, такими, как: Аl(OH)SO4 , Zn(OH)Cl и т.д.
• В составе двойных солей находится два различных катиона, которые получаются с помощью кристаллизации из смешанного раствора солей с разными катионами, но одинаковыми анионами.
• Но, а к смешанным солям относятся такие, в составе которых находятся два различных аниона.
• Также существуют комплексные соли, в состав которых входит комплексный катион или комплексный анион.
Применение солей
Соли нашли свое применение, как в производственных целях, так и в нашей повседневной жизни. А сейчас давайте рассмотрим более детально и узнаем, где и какие соли чаще всего применяются.
• Соли соляной кислоты
Из этого вида солей чаще всего используют хлорид натрия и хлорид калия. Поваренную соль, которую мы с вами употребляем в пищу добывают из морской, озерной воды, а также на соляных шахтах. И если хлорид натрия мы употребляем в пищу, то в промышленности его используют для получения хлора и соды. А вот хлорид калия незаменим в сельском хозяйстве. Его применяют, как калийное удобрение.
• Соли серной кислоты
Что же касается солей серной кислоты, то они нашли широкое применение в медицине и строительстве. С ее помощью изготавливают гипс.
• Соли азотной кислоты
Соли азотной кислоты, или как их еще называют нитраты, применяются в сельском хозяйстве в качестве удобрений. Самыми значимыми среди этих солей является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Их еще называют селитрами.
• Ортофосфаты
Среди ортофосфатов, одним из наиболее важных, является ортофосфат кальция. Эта соль входит в основу таких минералов, как фосфориты и апатиты, которые необходимы при изготовлении фосфорных удобрений.
• Соли угольной кислоты
Соли угольной кислоты или карбонат кальция можно встретит в природе, в виде мела, известняка и мрамора. Его используют для изготовления извести. А вот карбонат калия применяется, как составляющая сырья при производстве стекла и мыла.
Полезные свойства соли
Состав и наличие полезных веществ
Соль представляет собой минеральное вещество — хлорид натрия с
небольшим количеством примесей полезных минеральных солей. Зачастую
это: магний, кальций, цинк, железо, медь, марганец, калий, фосфор,
молибден, сера, кобальт.
Натрий это один из основных катионов, очень необходимых для осуществления
важнейших функций организма. Около половины всего натрия в нашем
организме находится во внеклеточной жидкости, в хрящах и костях
– 40%, а в клетках – 10%. Натрий также входит в состав крови, желчи,
поджелудочного сока, цереброспинальной жидкости, женского молока.
Еще натрий принимает участие в поддержании кислотно-щелочного
баланса, водно-солевого обмена, обеспечивает равновесие осмотического
давления. Также он необходим для качественной работы нервных окончаний,
мышечной деятельности, передачи нервных импульсов, для усвоения
кишечником и почками определенных питательных веществ.
Хлор участвует в образовании веществ, которые способствуют расщеплению
жиров. Он необходим также и в образовании основного компонента желудочного
сока — соляной кислоты. Хлор стимулирует работу центральной нервной
и половой систем, заботится о выведении мочевины из организма, способствует
формированию, росту костной ткани.
Соль – это жизненно важный элемент для людей, страдающих диабетом
первого типа. Это обусловлено способностью соли регулировать в крови
уровень сахара, снижая тем самым потребность в инсулине.
Для получения от соли пользы, следует использовать натуральную,
неочищенную соль. Обязательно нужно помнить о том, что столовая
мелкая соль не имеет полезных минералов.
Но не стоит забывать, что соль полезна только в умеренном, рекомендованном
количестве.
Полезные и лечебные свойства
Соль комплексно влияет на пищеварительную систему, что повышает
жизненный тонус. В ней, как упоминалось выше, содержится немалое
количество растворимых в воде полезных веществ, важных микроэлементов
и минералов. Небольшое количество соли в рационе питания делает
приступы удушья у астматиков
более редкими.
Соль содержит селен – это микроэлемент с замечательными антиоксидантными
свойствами. Он служит защитником клеток от губительного разрушения
свободными радикалами.
При помощи соли из организма выводятся вредные вещества. Она замечательно
справляется с отравлениями, так как замедляет процесс всасывания
слизистой кишечника ядовитых веществ, а также задерживает их поступление
в кровь. Соль участвует в борьбе организма с радиацией и другими
вредными излучениями. Еще она является источником образования в
желудочном соке соляной кислоты, что благотворно влияет на переваривание
пищи и убивает микробы.
В кулинарии
В кулинарии соль используют при приготовлении практически всех
блюд, как одну из важнейших приправ. Она обладает характерным вкусом,
что дает легкое определение ее избытка или недостатка в том или
ином блюде. Недосоленная еда кажется пресной, а пересоленную вообще
невозможно употреблять. Поваренной соли характерны антисептические
свойства, позволяющие использовать ее в консервации, засолке
рыбы и мяса для их продолжительного хранения.
В косметологии
Очень часто соль используют в косметологии. Ее добавляют в кремы,
гели, шампуни, скрабы. Это дает возможность восстанавливать в коже
минеральный баланс. Амбразивность соли помогает открыть поры и очистить
кожу от омертвевших клеток. Поэтому ее часто применяют во время
проведения пиллингов для придания шелковистости кожи.
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН-. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Химический состав пищевой соли
Формула пищевой соли известна каждому школьнику – NaCl. Но абсолютно чистый натрий хлор вы не встретите ни в природе, ни в продаже. В веществе содержится от 0,3 до 1% различных минеральных примесей.
Состав поваренной пищевой соли регламентирован ГОСТом Р 51574-2000, который мы уже упоминали выше. Нормативы:
| Наименование показателя | Экстра | Высший сорт | Первый сорт | Второй сорт |
|---|---|---|---|---|
| Хлористый натрий,%, не менее | 99,70 | 98,40 | 97,70 | 97,00 |
| Кальций-ион,%, не более | 0,02 | 0,35 | 0,50 | 0,65 |
| Магний-ион,%, не более | 0,01 | 0,05 | 0,10 | 0,25 |
| Сульфат-ион,%, не более | 0,16 | 0,80 | 1,20 | 1,50 |
| Калий-ион,%, не более | 0,02 | 0,10 | 0,10 | 0,20 |
| Оксид железа(III) ,%, не более | 0,005 | 0,005 | 0,010 | |
| Сульфат натрия,%, не более | 0,20 | Не нормируется | ||
| Нерастворимый остаток,%, не более | 0,03 | 0,16 | 0,45 | 0,85 |
По этому же ГОСТу соль представляет собой кристаллический сыпучий продукт без примесей, за исключением связанных с его производством. Натрий хлор имеет соленый вкус без посторонних привкусов. В соли высшего, первого и второго сорта могут находиться темные частицы, в пределах содержания оксида железа и нерастворимого в воде остатка.
Соляная кислота как профессиональная вредность
Вредным действием обладает аэрозоль С. к., находящийся в воздухе рабочей зоны; кроме того, при работе с С. к. необходимо учитывать возможность образования в воздухе других токсических соединений, напр, мышьяковистого водорода AsH3 (см. Мышьяк).
При высоких концентрациях хлористого водорода в воздухе производственных помещений отмечают раздражение слизистых оболочек дыхательных путей с насморком, кашлем вплоть до удушья, в мокроте иногда может появляться кровь; возможны конъюнктивиты, помутнение роговицы. Хрон. воздействие аэрозоля С. к. может привести к развитию гипертрофических и атрофических ринитов (см.), иногда с изъязвлениями слизистой оболочки носа вплоть до прободения носовой перегородки, трахеитов (см.), бронхитов (см.), разрушению зубов, жел.-киш. расстройствам; возможны воспалительные заболевания кожи.
Аэрозоль С. к. вызывает резкую болезненность кожи лица. Ожоги соляной кислотой не так тяжелы, как ожоги азотной кислотой (см.) и серной кислотой (см.). Острые проф. отравления, вызванные вдыханием аэрозоля С. к., встречаются чрезвычайно редко. Клин, картина острого отравления аэрозолем С. к. характеризуется кашлем, тяжелым учащенным дыханием; в легких слышны мелкопузырчатые хрипы, мокрота отхаркивается с большим трудом, возможен отек гортани и голосовых связок; слабость, кожа горячая и сухая, землистого цвета, острые боли в области желудка, частая рвота желтоватой слизью. При попадании С. к. внутрь развивается клин, картина отравления (см.): сильные боли в области пищевода и желудка, гиперсаливация, неукротимая рвота темньгми массами, содержащими некротизированные элементы слизистой оболочки желудка, двигательное возбуждение, судороги, бледность или цианоз лица, пульс слабый, частый, аритмичный; возможен коллапс. Смерть наступает в первые часы и даже минуты от шока или асфиксии вследствие отека гортани, реже — через несколько суток от разлитого перитонита, если произошло прободение желудка, или других осложнений (бронхопневмоний, нефрозонефрита и др.).
